ICHQ2分析法バリデーションには確認試験には分析能として「特異性」が必要であるとされています。
(1) また標準品と測定対象原料の同一性評価方法として両スペクトルの一致が局方で規定されています。
(2) 現在はこれらの規格、基準を参考にしてPIC/Sの受入れ時の確認試験においては、t検定などの統計処理を使って標準品と原料の同一性の評価を行っています。この同一性評価に使用される標準品のラマンスペクトルについてスペクトルの官能基の帰属が必要であることが考えられます。赤外吸収スペクトル,核磁気共鳴スペクトル等のスペクトルでは吸収の帰属も記載し,液体クロマトグラフィーなどにおいては分析法バリデーションも提出すること
(3) やFDAの査察時に製薬企業に対して標準品と吸収パターンが似ているというだけでなく、その構造を決定づける特異な吸収ピークがすべて存在することを確認することと指摘・指導があった
(4) さらに、スペクトル中の主要な吸収帯及び有効成分の構造の確認に有用な吸収帯をできるだけ広い波数域にわたるように選択する。なお構造上特徴的な官能基は原則として帰属される必要がある
(3) など確認試験に関する関連法令、査察実態などを考慮して今後の
PIC/S対応の受け入れ時の確認試験分析法バリデーションサービスにおいて標準品のラマンスペクトルに対して官能基の帰属が必要と考えられます。
当社では、今後PIC/S対応受け入れ時の確認試験分析法バリデーションのオプションとしてスペクトルの官能基帰属サービスの提供実施しております。なお、官能基の帰属を実施するかしないのご判断は、医薬品の品質を考慮して製造者が独自に決定することが必要
(5) であると考えています。
【見本】
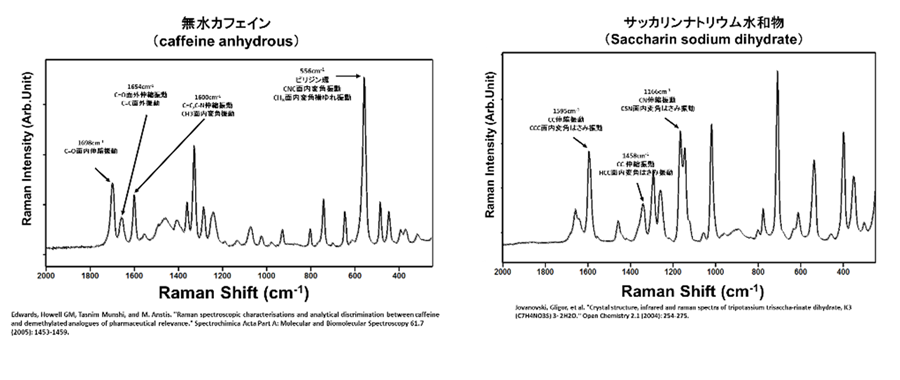
【弊社主なサービス内容】
商品名:ラマンスペクトルの帰属サービス
価格:弊社へお問い合わせください
スペクトルの帰属の条件:
*特許期間中の原薬のラマンスペクトルについては対象外
*対象原薬・添加剤の一部はスペクトルの帰属が不可能な場合があります。その際の対応は打ち合わせとします。
*ラマンスペクトルの帰属の引用元は「原則」査読付き論文とします。
*対象原料(原薬、添加剤)の個数は最大10個までとします。
【引用】
(1) 分析法バリデーションに関するテキスト(実施項目)について平成7年7月20日薬審第755号 各都道府県衛生主管部(局)長あて厚生省薬務局審査課長通知 平成9年10月28日 医薬審第338号一部改正
(2) 日本薬局方
(3) 第十七改正日本薬局方医薬品各条 原案作成要領の実務ガイド 追補2 2016年3月
(4) 浮島美之、「医薬品の品質管理と分析法バリデーション」、国立保健医療科学院、1994 公衆衛生研究. 43(4)
(5) GMP省令 第3章 第4 2.バリデーション基準(2)

